金属材料在日常生活、工农业生产中有广泛应用,结合所学知识回答下列问题:
(1)金属的冶炼、使用、保护等往往需要考虑其活动性顺序,请将金属活动性顺序补充完整 ZnZn。
①战国《韩非子•内储说上》提到,早期采金技术均是“沙里淘金”。金在自然界中主要以 单质单质(填“单质”或“化合物”)形式存在。
②战国时期脱碳窑遗址的发现证明了我国古代冶铁技术的高超水平。赤铁矿(主要成分为Fe2O3)与CO在高温下反应的化学方程式为 Fe2O3+3CO高温 2Fe+3CO2Fe2O3+3CO高温 2Fe+3CO2。
(2)金属在使用过程中要注意防止锈蚀,铁生锈的条件是 与氧气和水同时接触与氧气和水同时接触;某校研究学习小组打开计算机软件,连接3个氧气传感器并校准至数值相同。在如图1所示的配套容器中分别放入等质量的铁丝绒,分别倒入10mL纯净水、10mL氯化钠溶液和10mL氢氧化钠溶液,立即同时插入3个氧气传感器,并开始采集数据。300s后停止采集,可以得到实验数据如图2所示。
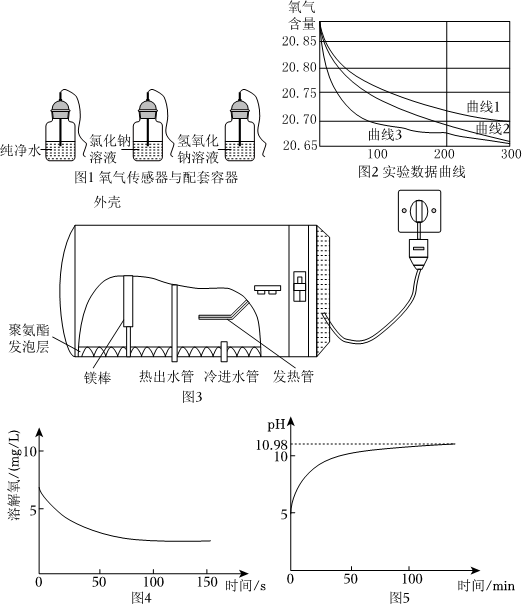
图2实验数据中:
曲线1表示铁丝绒滴入水后氧气含量的变化情况;
曲线2表示铁丝绒滴入氯化钠溶液后氧气含量的变化情况;
曲线3表示铁丝绒滴入氢氧化钠溶液后氧气含量的变化情况。
分析对比图中曲线,可以得出的结论是 相同条件下,氢氧化钠和氯化钠可以加速铁丝的腐蚀(合理即可)相同条件下,氢氧化钠和氯化钠可以加速铁丝的腐蚀(合理即可)。
(3)在生产生活中使用广泛。如图3是一种市售的储水式电热水器结构,热水器中的聚氨酯泡沫塑料发泡层是一种保温材料,聚氨酯属于 合成合成材料,热水器外壳通常采用的防锈方法是 喷漆喷漆。
储水式电热水器中的镁棒能降低水中溶解氧的含量,减弱了铁制水箱所受到的腐蚀。受此启发,某校兴趣小组将经过打磨的镁条放入冷水中,但实验中发现镁的表面缓慢生成细小气泡,反应难以持续进行,不能持续有效的消耗溶解氧,于是他们请教了老师,老师告诉他们:镁条放入冷水中,在镁的表面生成了很多细小的气泡并附着在镁的表面,阻止了镁和水的进一步接触,同时镁表面生成的氢氧化镁也对镁和水的接触存在隔离作用。生产自来水时加入的含氯消毒剂产生了Cl-,一定浓度的Cl-会破坏表面的Mg(OH)2,从而加速了镁和水的反应。
实验1:同学们取来某浓度的氯化钠溶液放入烧杯中,将打磨过的镁条放入其中,同时在溶液中放入溶解氧传感器,发现镁表面产生大量的气泡,在溶液底部产生了大量白色沉淀。实验过程中,溶解氧的变化如图4所示:
由图4可知,溶氧量下降,氧气参加了反应。试写出水中镁条和溶解氧发生化合反应生成氢氧化镁的化学反应方程式 2H2O+2Mg+O2=2Mg(OH)22H2O+2Mg+O2=2Mg(OH)2。
实验结束后,同学们又产生了新的疑问:Cl-对表面Mg(OH)2的破坏是化学变化吗?烧杯底部的白色沉淀一定是氢氧化镁吗?
实验2:他们重复上面的实验,将溶解氧传感器换成了pH传感器,测得数据如图5,由图5可知烧杯中溶液的碱性不断 增强增强(填“增强”或“减弱”),最终pH=10.98。
他们查阅资料得知,相同条件下饱和氢氧化镁溶液的pH约为10.5。因此他们认为白色沉淀不全是氢氧化镁。
白色沉淀是什么呢?老师告诉他们,在一定浓度的Cl-存在的条件下,Mg(OH)2可以转化成碱式氯化镁【Mg(OH)Cl】,碱式氯化镁加热能分解成氧化镁和氯化氢;碱式氯化镁溶于酸能形成可溶性的盐酸盐。请根据以上信息,设计实验证明白色沉淀中含有碱式氯化镁(写出实验操作、现象、结论)。过滤实验后烧杯中的物质,将所得滤渣充分洗涤、干燥、取滤渣加热,将生成的气体通入硝酸银溶液中,若产生白色沉淀,则滤渣中含碱式氯化镁(合理即可)取滤渣加热,将生成的气体通入硝酸银溶液中,若产生白色沉淀,则滤渣中含碱式氯化镁(合理即可)。
F
e
2
O
3
+
3
CO
高温
2
F
e
+
3
C
O
2
F
e
2
O
3
+
3
CO
高温
2
F
e
+
3
C
O
2
【答案】Zn;单质; ;与氧气和水同时接触;相同条件下,氢氧化钠和氯化钠可以加速铁丝的腐蚀(合理即可);合成;喷漆;2H2O+2Mg+O2=2Mg(OH)2;增强;取滤渣加热,将生成的气体通入硝酸银溶液中,若产生白色沉淀,则滤渣中含碱式氯化镁(合理即可)
F
e
2
O
3
+
3
CO
高温
2
F
e
+
3
C
O
2
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/29 8:0:9组卷:28引用:2难度:0.5
相似题
-
1.如图1为实验室常用的制取气体的实验装置。
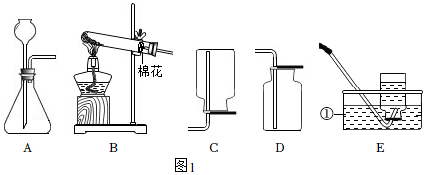
(1)写出标有序号的仪器名称:①。
(2)用装置B和E组合制取氧气,反应方程式为,若实验结束时先熄灭酒精灯,再移出导气管,导致的后果为。
(3)实验室用稀硫酸和锌粒制取氢气的反应方程式为,用A装置做发生装置,检查装置气密性时用止水夹夹紧导管,向长颈漏斗中加入水,若出现现象,则气密性良好。
(4)实验室用未知浓度的盐酸和大理石制取二氧化碳,反应方程式为。同学们将制得的气体通入澄清石灰水,未变浑浊。猜想可能的原因是:
①澄清石灰水已变质;
②气体中除了有CO2外,还有氯化氢气体。
经过讨论设计如图2装置进行探究。试管I、试管Ⅱ盛放AgNO3溶液,试管Ⅲ中盛放原瓶中的澄清石灰水。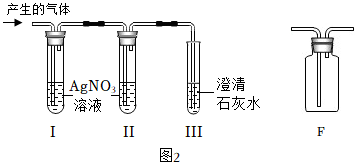
实验过程:
根据试管I中的现象,试管Ⅱ中硝酸银溶液未变浑浊,试管Ⅲ中的现象,同学们得出猜想①②两个原因均存在的结论。
问题讨论:
①试管Ⅱ中AgNO3溶液的作用为。
②同学们用F装置除去CO2中的氯化氢气体,F装置中的药品可选用(填序号)。
A.NaOH溶液
B.AgNO3溶液
C.饱和NaHCO3溶液发布:2024/12/24 8:0:11组卷:83引用:3难度:0.6 -
2.实验小组研究几种常用胃药的抗酸效果。
【查阅资料】
i.溶液的pH越大,酸性越弱。人体胃液的主要成分为盐酸,正常pH范围为0.9~1.5。
ⅱ.三种胃药的有效成分如下。胃药使用不当,可能导致胃胀气等症状。
【进行实验】胃药a 胃药b 胃药c 碳酸氢钠
NaHCO3铝碳酸镁
Al2Mg6(OH)16CO3•4H2O氢氧化铝
Al(OH)3
实验一:验证胃药是否能抗酸
各取25mLpH=1.20的稀盐酸放入三个小烧杯中,分别加入有效成分质量相同的三种胃药,搅拌120s,观察实验现象并用pH传感器测定反应后溶液的pH。
(1)胃药a和胃药b产生的气体均为CO2,实验室检验该气体的试剂是现象 反应后溶液的pH 胃药a 产生大量气体 6.37 胃药b 产生极少量气体 4.25 胃药c 无气体 1.34 。
(2)胃药c中的氢氧化铝与盐酸发生中和反应,其化学方程式为。
(3)由实验一可知三种胃药都能抗酸,依据是。
实验二:探究影响胃药抗酸效果的因素
下表所示实验中,均取25mLpH=1.20的稀盐酸,加入胃药,搅拌,用pH传感器测定一定反应时间后溶液的pH(反应后pH越大,抗酸效果越好)。
(4)探究反应时间对胃药抗酸效果的影响的实验组合是实验编号 胃药种类 有效成分质量/g 反应时间/s 溶液的pH ① 胃药a 0.5 60 6.02 ② 胃药a 0.5 120 6.37 ③ 胃药a 0.5 180 6.54 ④ 胃药b 0.5 60 3.93 ⑤ 胃药b 0.5 120 4.25 ⑥ 胃药b 0.5 180 4.70 ⑦ 胃药c 0.5 60 1.26 ⑧ 胃药c 0.5 120 1.34 ⑨ 胃药c 0.5 180 1.42 (填序号,任写一个组合)。
(5)由实验二可知,胃药种类对抗酸效果的影响的结论是。
【反思与评价】
(6)实际应用中,胃药b比胃药a、c使用得更多。结合上述实验,说明胃药b具有的优势是。发布:2024/12/25 13:0:1组卷:179引用:2难度:0.5 -
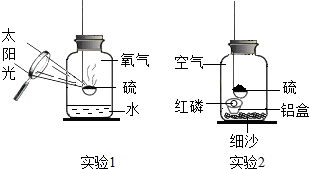 3.寿春中学化学组的同学设计了硫在氧气中燃烧的改良实验,如实验1.当火焰熄灭后发现留有剩余,硫为什么会熄灭呢?每个人都提出了自己的猜想.
3.寿春中学化学组的同学设计了硫在氧气中燃烧的改良实验,如实验1.当火焰熄灭后发现留有剩余,硫为什么会熄灭呢?每个人都提出了自己的猜想.
【猜想】
甲同学猜想:硫燃烧耗尽了瓶内的氧气,所以它熄灭了;
乙同学猜想:硫燃烧后瓶内的二氧化硫(不支持硫的燃烧)浓度过高导致硫熄灭了;
丙同学猜想:甲和乙都只看到了问题的一个方面,他认为甲和乙都有道理;
丁同学猜想:.
【设计实验】丁同学设计了实验2进行实验验证自己的猜想:
【实验反思】(1)硫燃烧的化学方程式为实验步骤 实验现象 实验分析 实验结论 (1)把少量红磷放在铝制小盒内,然后放入装有细沙的集气瓶,塞紧瓶塞,用放大镜点燃硫,观察现象. 硫燃烧一会儿就熄灭了. 磷燃烧需满足的条件:①温度达到着火点;
②丁同学的猜想正确. (2)待冷却后,用放大镜聚光加热铝盒内的红磷,观察现象. 红磷燃烧,放出热量的同时产生了 ;实验2中硫燃烧的火焰颜色是色.
(2)实验1与课本实验相比,实验1的优点是;
(3)实验2中细沙的作用是.
(4)实验室中测定空气中氧气体积分数实验不用硫代替红磷的原因是.发布:2024/12/2 8:0:1组卷:31引用:1难度:0.5


