氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子交换膜只允许阳离子通过。

回答下列有关问题:
(1)图中X是 Cl2Cl2(填化学式),图中a% <<c%(填“>”或“<”或“=”)。
(2)电解池的阴极反应式为 2H2O+2e-=2OH-+H2↑2H2O+2e-=2OH-+H2↑。
(3)通入空气的电极的电极反应式为 O2+4e-+2H2O=4OH-O2+4e-+2H2O=4OH-,燃料电池中阳离子的移动方向 从左向右从左向右(“从左向右”或“从右向左”)。
(4)写出电解饱和食盐水的化学方程式 2NaCl+2H2O 通电 2NaOH+H2↑+Cl2↑2NaCl+2H2O 通电 2NaOH+H2↑+Cl2↑,电解池中产生2molCl2,理论上燃料电池中消耗O2的物质的量为 11mol。
(5)在工业上利用电解NaOH溶液可以生产Na2FeO4,装置如图。

①阳极的电极反应式为 Fe-6e-+8OH-=FeO2-4+4H2OFe-6e-+8OH-=FeO2-4+4H2O。
②右侧的离子交换膜为 阴阴(填“阴”或“阳”)。
2
H
2
O
+
2
e
-
=
2
O
H
-
+
H
2
↑
2
H
2
O
+
2
e
-
=
2
O
H
-
+
H
2
↑
通电
通电
F
e
-
6
e
-
+
8
O
H
-
=
F
e
O
2
-
4
+
4
H
2
O
F
e
-
6
e
-
+
8
O
H
-
=
F
e
O
2
-
4
+
4
H
2
O
【考点】氯碱工业.
【答案】Cl2;<;;O2+4e-+2H2O=4OH-;从左向右;2NaCl+2H2O 2NaOH+H2↑+Cl2↑;1;;阴
2
H
2
O
+
2
e
-
=
2
O
H
-
+
H
2
↑
通电
F
e
-
6
e
-
+
8
O
H
-
=
F
e
O
2
-
4
+
4
H
2
O
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/6/10 8:0:9组卷:69引用:2难度:0.7
相似题
-
1.2023年8月24日,日本执意将福岛核电站核污水排放大海,引起了世界各国的激烈反对,人类将铭记这沉重的一天。海水(主要阳离子为:Na+、Mg2+、Ca2+等)可为人类提供大量的工业原料,在化工生产中发挥着重要的作用。
下面是现代化氯碱工业流程及部分物质溶解度曲线: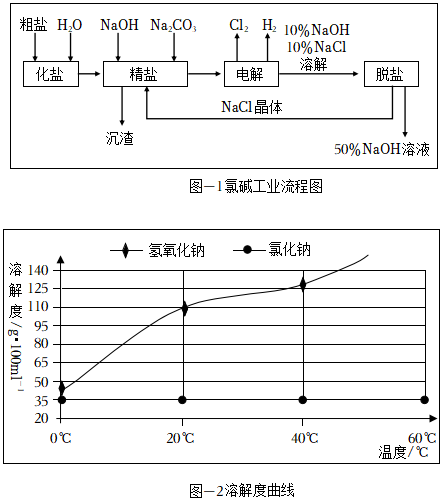
(1)工业制备氯气的化学反应方程式为:;
(2)制备精盐溶液过程中会产生沉渣,沉渣的主要成分为;
(3)氯碱工业的主要产物可以直接混合制备消毒剂,且产物是“84消毒液”主要成分,该消毒剂制备的原理是:(写化学方程式)
(4)“脱盐”操作可获取NaCl晶体,同时富集NaOH,请回答:
①获取NaCl晶体的实验流程为(填操作名称)、趁热过滤、冷水洗涤;
②使用冷水洗涤的目的是:;补充洗涤操作步骤:过滤完毕后,。发布:2024/10/11 18:0:1组卷:36引用:1难度:0.7 -
2.氯碱工业的装置图如图,下列说法正确的是( )
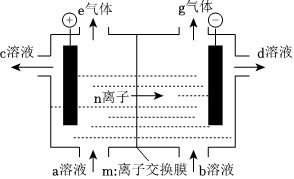 发布:2024/7/13 8:0:9组卷:59引用:1难度:0.6
发布:2024/7/13 8:0:9组卷:59引用:1难度:0.6 -
3.氯碱工业是化工产业的重要基石,其装置示意图如图1所示。已知pH升高时,ClO-易歧化为ClO-和Cl-。
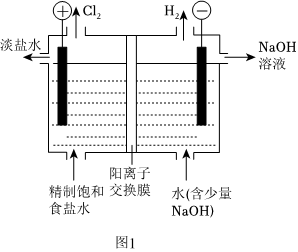
(1)电解饱和食盐水的离子方程式为。
(2)阴极生成22.4LH2(折合成标准状况)时,有molNa+穿过交换膜向极迁移(选填“阴”或“阳”)。
(3)中Cl-采取ClO-3杂化,离子的空间构型是ClO-3形。副产物的产生有两种可能途径:ClO-3
①Cl-在电极上放电形成。写出该电极反应方程式:ClO-3。
②阳离子交换膜破损导致OH-向阳极室迁移,发生2步反应最终产生:ClO-3,。
(4)测定副产物含量的方法如图2所示。ClO-3
①加入H2O2的目的是除去水样中残留的Cl2和ClO-。若测定中未加入H2O2,则测得水样中的浓度将ClO-3(选填“偏大”“偏小”或“无影响”)。
②滴定至终点时,消耗V3mL酸性KMnO4溶液,则水样中c()=ClO-3mol•L-1。发布:2024/9/17 4:0:8组卷:42引用:1难度:0.7


