当前位置:
知识点挑题
请展开查看知识点列表
>
<
更多>>
 已完结
已完结
|
开学模拟
温故知新
夯实基础
稳步提升
浏览次数:154
更新:2025年07月15日
|
|
原创
 已完结
已完结
|
暑假预习
夯实基础
活学活用
人教版(2019)
浏览次数:662
更新:2025年07月07日
|
11.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:

(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示:.
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,当pH=5时,溶液中c(Al3+)为mol•L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,碳酸氢铵与硫酸亚铁反应的离子方程式为.若用等物质的量的碳酸铵替代碳酸氢铵,则产品中可能混有的杂质是.
(5)A的操作是.
(6)m g烧渣经过上述工艺可得红氧化铁n g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含m、n的表达式表示).发布:2025/1/19 8:0:1组卷:5引用:3难度:0.512.碳酸亚铁(FeCO3)是一种重要的工业盐,可用于制备补血剂,也是炼铁所用铁矿的主要成分,其外观为白色固体,难溶于水。某研究小组制备了FeCO3,并对FeCO3的性质和应用进行了探究。
已知:Fe2++6SCN-⇌[Fe(SCN)6]4-(无色)
用如图装置制备FeCO3(夹持装置略):
(1)装置c的名称为。
(2)打开a中K1、K3,关闭K2,一段时间后,关闭K3,打开K2。在装置(填装置序号)中制得碳酸亚铁沉淀。该操作过程中产生的气体的作用是:。
(3)用以上方法制得的碳酸亚铁纯度不高,可能含有的主要杂质是(写化学式)。若用NaHCO3溶液代替Na2CO3溶液制备碳酸亚铁,获得的产品纯度更高,该反应的离子方程式为。
(4)研究小组为了探究FeCO3的性质,将制得的产品过滤、洗涤、干燥后在空气中煅烧,发现有红棕色固体生成,请写出相应的化学反应方程式。
(5)通过以下两个实验进一步探究FeCO3的性质:
实验ⅰ: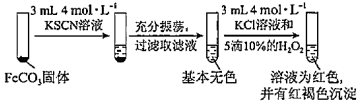
实验ⅱ:
对比实验ⅰ和ⅱ,得出的实验结论是。发布:2025/1/19 8:0:1组卷:7引用:1难度:0.613.查阅资料:CaO、MgO在高温下与C难反应,但能与SiO2反应.硫铁矿烧渣是一种工业废渣(含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质),该烧渣可用于制取氧化铁,具体化工生产工艺流程如下:
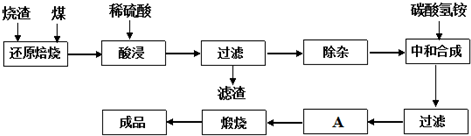
(1)焙烧时产生的主要有害气体是.
(2)若在空气中“酸浸”时间过长,溶液中Fe2+含量将下降,其原因是:(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,检验Fe3+已经除尽的试剂是(除KSCN外).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.发布:2025/1/19 8:0:1组卷:12引用:1难度:0.1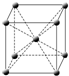 14.下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
14.下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
(1)元素a和元素b的简单氢化物熔点较高的是a b c d e f (用化学式填空),其原因是.
(2)a和d可形成不同晶体,下列说法正确的是(NA是阿伏加德罗常数).
A.元素a的单质可能是原子晶体或分子晶体
B.mg d元素形成的晶体中,含共价键数目为m NA/7
C.元素a与元素d形成的化合物40g,含NA个分子
D.元素d的最高价氧化物6g,含共价键物质的量为0.4mol
(3)c和e形成的化合物的中,每个阳离子周围距离最近且等距离的阳离子有个,一个晶胞中的阴离子数目为个.晶体中阳离子和阴离子核间距为a cm,该化合物相对分子质量为M,NA为阿伏加德罗常数,则晶体密度为g/cm3.
(4)f原子的外围电子排布式为,其晶胞结构如图,f单质的晶体密度为ρg/cm3,f相对原子质量为M,阿伏加德罗常数NA,则f的原子半径为.发布:2025/1/18 8:0:1组卷:8引用:1难度:0.315.A、B、C、D、E为原子序数依次增大的五种短周期元素;A是宇宙中最丰富的元素且与E同主族;B位于元素周期表ⅣA族;C在元素周期表中与B、D相邻;D基态原子的s轨道与p轨道的电子总数相等且p轨道有2个未成对的电子;E是短周期中原子半径最大的元素;F原子核外电子数为29.回答下列问题:
(1)F基态原子的核外电子排布式为。
(2)A、B、C、D、E五种元素中,电负性最小的元素为(填元素符号,下同),第一电离能最大的元素为;A3D+的立体构型为。
(3)A、B可形成多种化合物,其中相对分子质量为28的分子,其中心原子的杂化方式为,该分子中σ键和π键的数目之比为。
(4)化合物BD2和E2D2的晶体类型分别为、。
(5)F单质为面心立方晶体,若F的相对原子质量为M,阿伏加德罗常数为NA,晶胞边长为a cm,则晶体F的密度ρ=g•cm-3。发布:2025/1/18 8:0:1组卷:28引用:2难度:0.3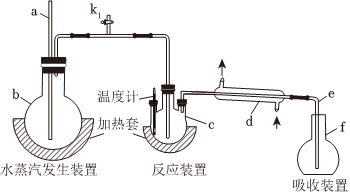 16.为测定某氟化稀土样品中氟元素的质量分数进行如下实验。利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再通过滴定测量,实验装置如图所示。(1)a的作用是 ,f仪器的名称是(2)检查装置气密性:首先(填操作),关闭k1,微热c,f中有气泡冒出;停止加热,导管e内形成一段稳定的水柱,说明装置气密性良好。(3)c中加入一定体积高氯酸和mg氟化稀土样品,f中盛有滴加酚酞的NaOH溶液。加热b、c,使水蒸气进入c。①下列物质可代替高氯酸的是(填序号)A.硝酸 B.盐酸 C.硫酸 D.磷酸②实验中除有HF气体外,可能还有少量SiF4(易水解)气体生成,若有SiF4生成,实验结果将(填“偏高”“偏低”或”不受影响”)。③若观察到f中溶液红色褪去,需要向f中及时补加NaOH溶液,否则会使实验结果偏低,原因是。(4)向馏出液中加入V1mL c1 mol/L La(NO3)3溶液,得到LaF3沉淀,再用c2mol/L EDTA标准溶液滴定剩余的La3+(La3+与EDTA按1:1络合),消耗EDTA标准溶液V2 mL,则氟化稀土样品中氟的质量分数为。(F的相对原子质量为19)(5)用样品进行实验前,需要用0.084g氟化钠代替样品进行实验,改变条件(高氯酸用量、反应温度、蒸馏实验),测量并计算出氟元素质量,重复多次。该操作的目的是。发布:2025/1/18 8:0:1组卷:24引用:1难度:0.5
16.为测定某氟化稀土样品中氟元素的质量分数进行如下实验。利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再通过滴定测量,实验装置如图所示。(1)a的作用是 ,f仪器的名称是(2)检查装置气密性:首先(填操作),关闭k1,微热c,f中有气泡冒出;停止加热,导管e内形成一段稳定的水柱,说明装置气密性良好。(3)c中加入一定体积高氯酸和mg氟化稀土样品,f中盛有滴加酚酞的NaOH溶液。加热b、c,使水蒸气进入c。①下列物质可代替高氯酸的是(填序号)A.硝酸 B.盐酸 C.硫酸 D.磷酸②实验中除有HF气体外,可能还有少量SiF4(易水解)气体生成,若有SiF4生成,实验结果将(填“偏高”“偏低”或”不受影响”)。③若观察到f中溶液红色褪去,需要向f中及时补加NaOH溶液,否则会使实验结果偏低,原因是。(4)向馏出液中加入V1mL c1 mol/L La(NO3)3溶液,得到LaF3沉淀,再用c2mol/L EDTA标准溶液滴定剩余的La3+(La3+与EDTA按1:1络合),消耗EDTA标准溶液V2 mL,则氟化稀土样品中氟的质量分数为。(F的相对原子质量为19)(5)用样品进行实验前,需要用0.084g氟化钠代替样品进行实验,改变条件(高氯酸用量、反应温度、蒸馏实验),测量并计算出氟元素质量,重复多次。该操作的目的是。发布:2025/1/18 8:0:1组卷:24引用:1难度:0.5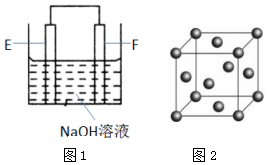 17.A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:
17.A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:
①A的周期序数等于其主族序数;
②B、D原子的L层中都有两个未成对电子;
③E元素原子最外层电子排布式为(n+1)Sn(n+1)Pn-1;
④F原子有四个能层,K、L、M全充满,最外层只有一个电子.
试回答下列问题:
(1)基态E原子中,电子占据的最高能层符号为,F的价层电子排布式为.
(2)B、C、D的电负性由大到小的顺序为(用元素符号填写),C与A形成的分子CA3的VSEPR模型为.
(3)B和D分别与A形成的化合物的稳定性:BA4小于A2D,原因是.
(4)以E、F的单质为电极,组成如图1所示的装置,E极的电极反应式为.
(5)向盛有F的硫酸盐FSO4的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色溶液,再向深蓝色透明溶液中加入乙醇,析出深蓝色晶体.蓝色沉淀溶解的离子方程式为.
(6)F的晶胞结构(面心立方)如图2所示:已知两个最近的F的距离为acm,F的密度为g/cm3(阿伏加德罗常数用NA表示,F的相对原子质量用M表示)发布:2025/1/18 8:0:1组卷:14引用:2难度:0.518.材料与化学密切相关,表中对应关系错误的是( )
材料 主要化学成分 A 刚玉、金刚石 三氧化二铝 B 大理石、石灰石 碳酸钙 C 普通水泥、普通玻璃 硅酸盐 D 沙子、石英 二氧化硅 发布:2025/1/16 8:0:1组卷:75引用:7难度:0.919.材料与化学密切相关,表中对应关系错误的是( )
材料 主要化学成分 A 普通水泥、普通玻璃 硅酸盐 B 刚玉、金刚石 三氧化二铝 C 大理石、石灰石 碳酸钙 D 光导纤维、石英 二氧化硅 发布:2025/1/16 8:0:1组卷:69引用:3难度:0.920.材料与化学密切相关,表中对应关系错误的是( )
选项 材料 主要化学成分 A 普通水泥、普通玻璃 硅酸盐 B 刚玉、金刚石 三氧化二铝 C 天然气、可燃冰 甲烷 D 光导纤维、石英 二氧化硅 发布:2025/1/16 8:0:1组卷:12引用:2难度:0.9



